महावीर सिंह की प्रयोगशाला जटिल प्रोटीन-न्यूक्लिक एसिड इंटरैक्शन के पीछे के रहस्यों को उजागर करना चाहती है

महावीर सिंह को प्रयोग करना पसंद है, चाहे वह कार्यस्थल पर प्रयोगशाला में हो या घर पर रसोई में। जब वह अपने बच्चों को चखने के लिए नई-नई रेसिपी बनाते हैं, तो उन्हें कभी-कभी मास्टरशेफ के प्रतियोगी जैसा महसूस होता है। वे कहते हैं, “उन्हें खुश करना बहुत मुश्किल है।” जब उनके खाना पकाने के प्रयोग असफल हो जाते हैं, तो महावीर इसे अपने बच्चों को यह सिखाने के अवसर के रूप में उपयोग करते हैं कि प्रयोगशाला में शोध भी इसी प्रकार की चुनौतियों से भरा होता है। मैं उन्हें कार्यस्थल का उदाहरण देता हूँ। अगर हम दस बार कोई प्रयोग करें और एक या दो बार में सफलता प्राप्त करें, तो मैं उसे सफलता मानूँगा। नई अवधारणाओं की खोज के शुरुआती चरण के दौरान 10-20% की सफलता दर काफी सराहनीय है, रसोई में किसी नई रेसिपी को परखने के समान।
पहाड़ी राज्य उत्तराखंड में पले-बढ़े, महावीर हमेशा शोध में करियर बनाने के बारे में निश्चित नहीं थे। दिल्ली में हाई स्कूल की पढ़ाई पूरी करने के बाद, शुरुआत में उनकी रुचि चिकित्सा में थी। “मुझे अच्छी रैंक नहीं मिली। मुझे डेंटल कॉलेज में दाखिला तो मिल गया, लेकिन मुझे पूरा यकीन था कि मैं डेंटिस्ट नहीं बनना चाहता।” उन्होंने दिल्ली विश्वविद्यालय के देशबंधु कॉलेज में जैव रसायन विज्ञान में स्नातक की पढ़ाई करने का फैसला किया, जहां उन्हें पहली बार अनुसंधान में रुचि पैदा हुई और अणुओं को देखने में रुचि विकसित हुई।
2001 में दिल्ली विश्वविद्यालय से बायोकेमिस्ट्री में मास्टर डिग्री पूरी करने के बाद, उन्होंने पीएचडी के लिए विदेश जाने का फैसला किया। “लेकिन 9/11 की वजह से अमेरिका जाना थोड़ा मुश्किल हो गया,” वे याद करते हैं। उन्होंने अपना ध्यान यूरोप की ओर लगाया और जर्मनी के मार्टिंसरीड में मैक्स प्लैंक इंस्टीट्यूट ऑफ बायोकेमिस्ट्री में बायोकेमिस्ट टैड होलक के साथ काम करने चले गए। “वहां मेरा समय बहुत अच्छा बीता। हम कोशिका चक्र को समझने पर काम कर रहे थे,” वे याद करते हैं। उनका शोध रेटिनोब्लास्टोमा प्रोटीन नामक कोशिका चक्र नियामक की संरचना को समझने पर केंद्रित था, जिससे उन्हें एक्स-रे क्रिस्टलोग्राफी और एनएमआर स्पेक्ट्रोस्कोपी जैसी विधियों में व्यावहारिक अनुभव प्राप्त करने का मौका मिला।
पीएचडी के बाद, उन्होंने अमेरिका के कैलिफोर्निया विश्वविद्यालय लॉस एंजिल्स (यूसीएलए) में जैव रसायन विभाग की प्रोफेसर जूली फेगन के अधीन पोस्टडॉक्टरल अध्ययन किया, जिनकी प्रयोगशाला यह समझने का प्रयास कर रही थी कि प्रोटीन डीएनए और आरएनए के साथ किस प्रकार अंतःक्रिया करते हैं। महावीर ने अपना ध्यान टेलोमेरेज़ नामक एंजाइम पर केंद्रित किया, जो गुणसूत्र के सिरों को बनाए रखता है – डीएनए और प्रोटीन का बंडल जो हमारे आनुवंशिक ब्लूप्रिंट को वहन करता है। महावीर बताते हैं कि टेलोमेरेज़ की संरचना और यह कैसे काम करता है, यह समझना महत्वपूर्ण है क्योंकि यह उम्र बढ़ने को नियंत्रित करने के साथ-साथ कैंसर कोशिकाओं को बढ़ने देने में भी महत्वपूर्ण भूमिका निभाता है। “लोग एक ऐसा अणु खोजना चाहते हैं जो कैंसर कोशिकाओं में टेलोमेरेज़ गतिविधि को रोक सके।”
जब महावीर यूसीएलए छोड़कर आईआईएससी में सहायक प्रोफेसर के रूप में शामिल हुए, तो उनकी दिलचस्पी गुणसूत्र में बनी रही। उनकी प्रयोगशाला ने यह समझने का प्रयास किया कि गुणसूत्र के अंतिम हिस्से, जिन्हें टेलोमेरेस कहा जाता है, किस तरह से पुनः निर्मित होते हैं। सामान्य परिस्थितियों में, इन सीधे सिरों को सुरक्षित रखने के लिए लूप या जटिल संरचनाओं में घुमाया जाता है जिन्हें क्वाड्रुप्लेक्स कहा जाता है। जब डीएनए की प्रतिलिपि (प्रतिकृति) बनाने की आवश्यकता होती है, तो इन लूप और संरचनाओं को खोलना पड़ता है, और प्रतिकृति समाप्त होने के बाद फिर से लूप करना पड़ता है। महावीर कहते हैं, “कहानी अधिक जटिल है क्योंकि आपके पास इन संरचनाओं से बंधे प्रोटीन का एक सेट भी है।”
उनकी प्रयोगशाला टेलोमेर डीएनए रीमॉडलिंग में शामिल प्रोटीन की भूमिका को ठीक से समझने की कोशिश कर रही है। एक प्रोटीन जिसने उनका ध्यान खींचा वह था hnRNPA1। कुछ साल पहले, उनकी प्रयोगशाला ने पाया कि इस प्रोटीन में एक “अव्यवस्थित” क्षेत्र है जो विशिष्ट टेलोमेर डीएनए और आरएनए क्वाड्रुप्लेक्स संरचनाओं पर ध्यान केंद्रित करता है, और उनसे जुड़ता है, जिससे प्रोटीन इन संरचनाओं को खोल सकता है। वे कहते हैं, “यह मेरी पहली स्नातक छात्रा मीनाक्षी घोष का काम था।” उन्होंने आगे कहा, इस प्रोटीन की भूमिका को समझना महत्वपूर्ण है, क्योंकि इसकी खराबी से कई बीमारियाँ जुड़ी हुई हैं, जैसे कि एमियोट्रोफिक लेटरल स्क्लेरोसिस (एएलएस), एक दुर्बल स्थिति जो रोगियों के मोटर नियंत्रण को धीरे-धीरे नष्ट कर देती है, और इसका कोई इलाज नहीं है।
इस तरह के प्रोटीन-न्यूक्लिक एसिड इंटरैक्शन का अध्ययन करने के लिए, महावीर की प्रयोगशाला बायोफिजिकल और स्पेक्ट्रोस्कोपिक तकनीकों के संयोजन का उपयोग करती है। इनमें से सबसे बहुमुखी है परमाणु चुंबकीय अनुनाद (एनएमआर) स्पेक्ट्रोस्कोपी, जो प्रोटीन संरचनाओं के पुनर्निर्माण के लिए परमाणुओं के चुंबकीय गुणों का लाभ उठाती है। एनएमआर स्पेक्ट्रा प्रोटीन में प्रत्येक अमीनो एसिड अवशेष के बारे में एक रीडआउट दे सकता है, लगभग एक ब्लूप्रिंट की तरह। जब प्रोटीन डीएनए या आरएनए से जुड़ता है, तो स्पेक्ट्रा में होने वाले संबंधित बदलावों से महावीर जैसे बायोफिजिसिस्ट यह पता लगा सकते हैं कि कौन से अवशेष डीएनए या आरएनए के किस रूप से बंध रहे हैं। वे कहते हैं, “हम यह भी माप सकते हैं कि बंधन की ताकत क्या है।”
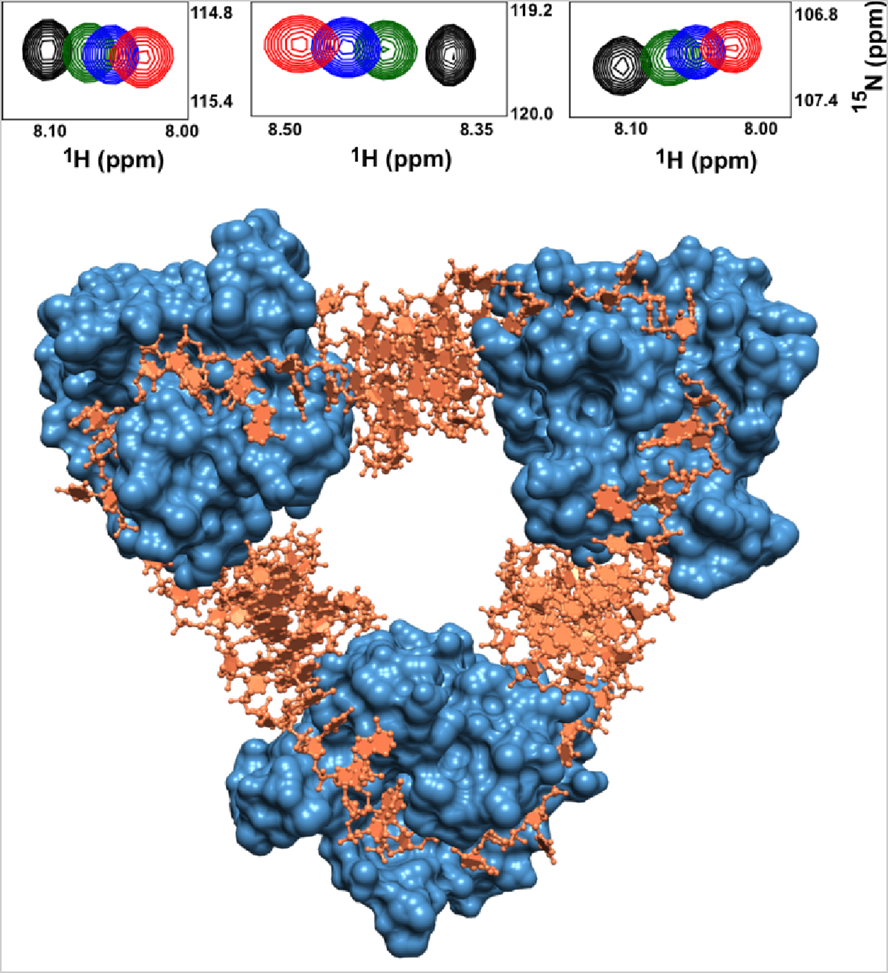
भारतीय विज्ञान संस्थान (आईआईएससी) का सदस्य बनने के बाद, महावीर को भारत सरकार के जैव प्रौद्योगिकी विभाग (डीबीटी) से उत्कृष्टता केंद्र अनुदान के माध्यम से वित्त पोषण से सम्मानित किया गया। इस अवसर ने उन्हें अपने शोध प्रयासों को वायरस के खिलाफ एक दिलचस्प जीवाणु रक्षा तंत्र की ओर पुनर्निर्देशित करने की अनुमति दी, जिसे टॉक्सिन-एंटीटॉक्सिन (टीए) प्रणाली के रूप में जाना जाता है। “वर्तमान में, मेरी प्रयोगशाला का आधा काम इसी विषय पर केंद्रित है,” वे कहते हैं।
जब कुछ वायरस बैक्टीरिया पर हमला करते हैं, तो वे बैक्टीरिया के डीएनए को हाईजैक कर लेते हैं, जिससे बैक्टीरिया वायरस की कई प्रतियां बाहर निकालता है, जिससे बैक्टीरिया की कोशिका फट जाती है, बैक्टीरिया मर जाता है और दूसरे बैक्टीरिया संक्रमित हो जाते हैं। वायरस को फैलने से रोकने के लिए, कुछ बैक्टीरिया परोपकारिता के तौर पर खुद को मार देते हैं। इस प्रक्रिया में एक मुख्य घटक दो जुड़े हुए वंशाणुों का संयोजन है जो एक विष और एक प्रतिविष उत्पन्न करते हैं। जबकि विष एक प्रोटीन अणु है, प्रतिविष या तो प्रोटीन या आरएनए हो सकता है। महावीर बताते हैं कि सामान्यतः, विष और प्रतिविष दोनों एक साथ उत्पन्न होते हैं और एक जटिल संरचना बनाते हैं, जिसमें प्रतिविष विष को निष्क्रिय कर देता है, जिससे बैक्टीरिया “खुशी से जीवित रह पाते हैं”। लेकिन वायरल संक्रमण के दौरान, जीवाणु इस कॉम्प्लेक्स को तोड़ने के लिए वायरस द्वारा जारी कुछ कारकों का उपयोग करता है, जिससे विष जीवाणु कोशिका को जहर देता है और मार देता है, जिससे वायरस भी मर जाता है।
महावीर की प्रयोगशाला एक असामान्य टीए कॉम्प्लेक्स में रुचि रखती है जिसे टाइप III टीए सिस्टम कहा जाता है, जहां एंटीटॉक्सिन कोई दूसरा प्रोटीन नहीं बल्कि आरएनए का एक हिस्सा होता है। टॉक्सिन और एंटीटॉक्सिन दोनों के लिए कोडिंग करने वाले जीन एक ही क्लस्टर में होते हैं। टॉक्सिन जीन को आरएनए में ट्रांसक्राइब किया जाता है और फिर टॉक्सिन प्रोटीन बनाने के लिए ट्रांसलेट किया जाता है, लेकिन एंटीटॉक्सिन जीन केवल आरएनए में ट्रांसक्राइब होता है। इस एंटीटॉक्सिन आरएनए की एक अनूठी उपस्थिति है – इसमें एक केंद्रीय हेयरपिन जैसी संरचना होती है जिसे स्यूडोनॉट कहा जाता है, जिसके दो सीधे सिरे होते हैं।
इस टीए प्रणाली की एक और असामान्य विशेषता यह है कि विष प्रोटीन वास्तव में एक एंजाइम है जो अपने स्वयं के एंटीटॉक्सिन आरएनए को टुकड़ों में काट देता है और फिर विष से बंध कर टीए कॉम्प्लेक्स बनाता है। महावीर की प्रयोगशाला ने दिखाया है कि ई. कोली बैक्टीरिया में कम से कम पाँच प्रकार के ऐसे कॉम्प्लेक्स (क्लस्टर) मौजूद हो सकते हैं। उन्होंने बैक्टीरिया में कसकर बंधे टॉक्सिन-आरएनए कॉम्प्लेक्स को दर्शाने वाली एक विस्तृत क्रिस्टल संरचना भी प्रकाशित की है।
महावीर बताते हैं, “अगले प्रयोगों में हम स्टैफिलोकोकस और साल्मोनेला जैसे रोग पैदा करने वाले बैक्टीरिया में अन्य अनोखे टाइप III TA कॉम्प्लेक्स पर काम करेंगे।” “हमारी रुचि इस कॉम्प्लेक्स के संयोजन में आरएनए एंटीटॉक्सिन में स्यूडोनॉट की भूमिका को ठीक से समझना है।”
ऐसे कॉम्प्लेक्स की संरचना को समझने से संक्रामक बैक्टीरिया को लक्षित करने और नए एंटीबायोटिक्स के लिए रास्ता बनाने में मदद मिल सकती है। महावीर कहते हैं, “आपको जो करना है, वह है एक ऐसा अणु या पेप्टाइड ढूंढना जो संक्रामक बैक्टीरिया में इस टीए कॉम्प्लेक्स को नष्ट कर सके, जिससे विष मुक्त हो जाए। और फिर यह विष बैक्टीरिया को खुद ही मार देगा।”
महावीर अपनी दिनचर्या का ज़्यादातर समय रिसर्च में बिताते हैं, लेकिन खाना बनाने और ताइक्वांडो जैसे अपने दूसरे शौक को पूरा करने के लिए भी समय निकालते हैं। वे बताते हैं, “मुझे ताइक्वांडो क्लास बहुत पसंद है।” “मुझे लगता है कि हर किसी को शौक के तौर पर मार्शल आर्ट अपनाना चाहिए। इसके कई फ़ायदे हैं।” वे कहते हैं कि उन्हें हर दिन जो चीज़ प्रेरित करती है, वह काफ़ी सरल है। “जब तक मैं अगला तार्किक प्रयोग कर सकता हूँ, मैं खुश हूँ।”







